Vsebina
- Glavna razlika
- Protonacija proti deprotonaciji
- Primerjalna tabela
- Kaj je protonacija?
- Kaj je deprotonacija?
- Ključne razlike
- Zaključek
Glavna razlika
Glavna razlika med protonacijo in deprotonacijo je v tem, da je protonacija dodajanje protona v kemični spojini, deprotoniranje pa je izločanje protona iz kemične spojine.
Protonacija proti deprotonaciji
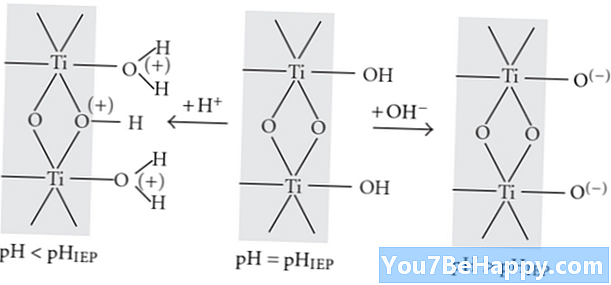
Protoniranje je kemični postopek, ki se zgodi med kemijskimi reakcijami, v katerih proton doda kemično spojino; na drugi strani pa je deprotonizacija postopek, ki se zgodi med kemijsko reakcijo, v kateri se proton odstrani iz kemične spojine. Protonacija je povečanje naboja +1 v atomu, molekuli, ionu ali spojini; na drugi strani pa je deprotonacija zmanjšanje naboja +1 atoma, iona, molekule ali spojine.
Atom, molekula ali spojina, ki je sodelovala pri protonaciji, se imenuje baza; Na drugi strani se atom, molekula ali spojina, ki sodeluje pri deprotonaciji, imenujejo kislina. Protonacija je postopek, pri katerem se pH kemične spojine poveča; nasprotno, deprotonizacija je postopek, pri katerem se pH raztopine kemične spojine zniža.
Protoniranje je postopek dodajanja, medtem ko je deprotonizacija postopek odstranitev ali izločanje. Protoniranje je kemični postopek, pri katerem dodana energija v kemijskih reakcijah; na stranski strani; deprotoniranje je kemični postopek, pri katerem se energija sprosti med reakcijami. Z drugimi besedami, protonacija je dodatek H+ v kemični spojini; po drugi strani pa je deprotonizacija odstranitev H+ iz kemične spojine.
Protonacija poveča naboj atoma, iona ali molekule; na drugi strani deprotonacija zmanjša naboj iona, atoma ali molekule. Med kislinsko-baznimi reakcijami so baze vedno podvržene kemijskim procesom protoniranja; po drugi strani pa kisline med kislinsko-baznimi reakcijami vedno potekajo v kemijskih procesih deprotonizacije.
Protonacija je kemični postopek pridobivanja konjugiranih kislin med kemičnimi procesi; na stranski strani; deprotoniranje je kemični postopek tvorjenja konjugacijske baze med kemijskim postopkom. Protonacija vedno povzroči nastajanje molekul vode iz hidroksilnih skupin spojine v kemijskih postopkih; Deprotonacija vedno povzroči proizvodnjo hidroksilnih molekul iz vodnih molekul v kemičnih procesih.
Protonacija je med organskimi reakcijami zelo hiter kemični postopek; po drugi strani pa je deprotonizacija med organskimi reakcijami zelo počasen proces. Protonacija je kemični postopek, ki stimulira izomerizacijski proces, medtem ko kemični postopek, ki stimulira izomerizacijski proces. Protonacija je naraščajoča stopnja kislega značaja; na drugi strani je deprotonizacija vse večja stopnja osnovnega značaja.
Primerjalna tabela
| Protoniranje | Deprotoniranje |
| Protoniranje je dodajanje protona v kemični spojini. | Deprotoniranje je izločanje protona iz kemične spojine. |
| Protoni | |
| Protoni dodajo spojino | Protone odstranimo iz spojine |
| Napolniti | |
| Poveča +1 naboj molekule | Zmanjša +1 naboj molekule |
| Stopnja kislosti ali bazičnost | |
| Stopnja osnovnosti | Stopnja kislosti |
| PH spojine | |
| Poveča pH spojine | Zmanjša pH spojine |
| Hitrost postopka | |
| To je hiter postopek | To je počasen proces |
| Postopek izomerizacije | |
| Stimulira postopek izomerizacije | Zavirajte postopek izomerizacije |
| Energija procesa | |
| Dodaja energijo reakciji | Iz reakcij sprošča energijo |
| Vrsta postopka | |
| Postopek dodajanja | Postopek odprave |
| H+ Ion | |
| V spojini dodajo vodikove ione | Vodikovi ioni izločajo iz spojine |
| Reverzibilnost | |
| Gre za reverzibilni postopek | Gre za nepovratni postopek |
| Katalitična sposobnost | |
| Ima katalitično moč | Nima katalitične moči |
Kaj je protonacija?
Protonacija je kemični postopek dodajanja protona v kemičnih spojinah med kemičnimi reakcijami. Gre za zelo hiter postopek. Iz hidroksilnih molekul lahko tvori vodne molekule. Protonacija je reverzibilni postopek, ki poveča naboj kemične spojine s hitrostjo +1 naboja v atomu, ionu, molekulah ali vrsti.
PH raztopin ali topil, vključenih v protonacijo, je zelo nizek. Protonacija je stopnja bazičnosti ali kislosti kemičnih ali organskih spojin. Protoniranje je postopek dodatka ali endotermike, ki sodeluje v procesu izomerizacije. Prav tako spodbuja postopek polimerizacije.
Ima katalitično moč za povečanje kislosti reakcij, ki se uporabljajo v več procesih, kot so adicijske reakcije, nukleofilne, elektrofilne reakcije, substitucijske reakcije itd. Proces protoniranja je sorazmeren stopnji kislega značaja snovi. Na splošno vključuje tvorjenje molekul vode med postopkom.
Vodikovi ioni se med postopkom protoniranja vedno seštevajo v kemični spojini. Ima tudi sposobnost spreminjanja optičnih lastnosti molekule. Postopek protoniranja spojin je odvisen od kislosti kislin, ki so na voljo raztopinam ali topilom. Proces protoniranja se uporablja za zmanjšanje reaktivnosti organskih molekul. Protonacija je na splošno znana kot endotermični postopek, ki vključuje sproščanje energije z dajanjem protona kemijskim vrstam zelo enostavno.
Postopek, kot je dodajanje vodika v molekuli amonijaka, ki povzroči nastanek amonijevih ionov, dodajanje vodikovih ionov v vodnih molekulah za nastajanje hidronijevih ionov, protoniranje hidroksilnega iona za tvorbo vodnih molekul, dodajanje vodikovih ionov alkoholom, da tvorijo hidronijeve ione v raztopini, dodajanje vodikovih ionov alkenom in alkinom itd. najbolje razloži izraz protonacija.
Kaj je deprotonacija?
Deprotoniranje je kemični postopek izločanja protonov iz kemičnih spojin med kemičnimi reakcijami. To je počasen proces. Ta postopek ima tudi sposobnost tvorjenja hidroksilnih ionov iz vodnih molekul. Deprotoniranje je nepopravljiv postopek, ki lahko zmanjša naboj kemične spojine s hitrostjo +1 naboja v atomu, molekuli ali ionskih vrstah.
PH raztopin ali topil, ki sodelujejo v postopku deprotonizacije, je zelo visok. Ta postopek ni sposoben izvajati kemičnih reakcij, če deluje kot katalizator. Proces protoniranja je sorazmeren osnovnemu značaju snovi. Vodni ioni se med deprotonizacijo vedno izločijo iz kemične spojine. Tudi njegove optične aktivnosti so spremenljive.
Postopek deprotonizacije je odvisen tudi od pH raztopin ali topil. Ta postopek poveča reaktivnost organskih molekul. Postopki, kot so odstranjevanje vodikovih ionov iz vode, da nastanejo hidroksilni ioni, odstranjevanje protona iz alkanov, da nastanejo alkeni in alkini, odstranjevanje vodikovih ionov iz alkoholov itd., Najbolje pojasnijo izraz deprotonacija.
Ključne razlike
- Protonacija je pojav dodajanja protona; po drugi strani pa je deprotonizacija odvzem protona.
- Protonacija vedno poveča pH kemijske raztopine; na drugi strani deprotonizacija vedno zniža pH kemične raztopine.
- Protonacija vedno doda naboj +1 kemični spojini; po drugi strani pa deprotoniranje vedno odstrani naboj +1 do kemične spojine.
- Protonacija je naraščajoča stopnja kislega značaja; na drugi strani je deprotonizacija vse večja stopnja osnovnega značaja.
- Protoniranje se zgodi zelo hitro; po drugi strani pa se deprotonacija pojavlja zelo počasi.
- Baze, ki se običajno uporabljajo v postopku protoniranja s sprejemanjem protona; nasprotno; deprotoniranje, ki se običajno uporablja v procesu deprotonizacije z odstranitvijo protonov.
- Dodajanje energije se pojavi v postopku protoniranja; na drugi strani se pri odstranjevanju energije zgodi odvzem energije.
- Protonacija poveča naboj atoma, iona ali molekule; na drugi strani deprotonacija zmanjša naboj iona, atoma ali molekule.
- Postopek protoniranja vključuje izomerizacijo kemičnih snovi; po drugi strani postopek deprotonizacije ne vključuje izomerizacije kemičnih snovi.
- Protoniranje je kemični postopek, ki se v bazah pojavi med kislinsko-baznimi reakcijami; depotoniranje je kemični postopek, ki se v kislinah zgodi med kislinsko-baznimi reakcijami.
- Protonacija v kemičnem postopku vedno proizvede konjugirano kislino; nasprotno, deprotoniranje v kemičnem postopku vedno ustvari konjugirano bazo.
- Protonacija naredi rešitev bolj koncentrirano; depotonizacija naredi, da raztopina postane manj koncentrirana.
- Protonacija vključuje izdelavo molekul vode; Po drugi strani pa deprotonacija vključuje proizvodnjo hidroksilnih molekul.
- Protoniranje je endotermični proces; po drugi strani pa je deprotonizacija eksotermični proces.
Zaključek
Zgornja razprava zaključuje, da je protonacija povečanje naboja +1 kemične spojine; na drugi strani pa je deprotonizacija zmanjšanje naboja +1 kemične spojine.